Cục Quản lý Dược đề nghị ngừng sử dụng thuốc Bupivacaine sau một số ca tử vong có liên quan
Mới đây, Cục Quản lý Dược – Bộ Y tế đã có công văn về việc về việc ngưng sử dụng Dung dịch thuốc tiêm Bupivacaine WPW Spinal 0,5% Heavy có SĐK: VN-20879-17, sau khi xuất hiện một số ca tử vong liên quan đến việc sử dụng Bupivacaine cho gây tê tủy sống.
Cục Quản lý Dược cho biết đã nhận được các công văn: Công văn số 2491/SYT-NVD ngày 22/10/2020 của Sở Y tế tỉnh Bình Dương báo cáo các ca nghi ngộ độc sử dụng Bupivacaine cho gây tê tủy sống và Công văn số 140/TTT ngày 22/10/2020 của Trung tâm DI & ADR quốc gia về việc cung cấp thông tin các báo cáo phản ứng có hại của thuốc liên quan đến Dung dịch thuốc tiêm Bupivacaine WPW Spinal 0,5% Heavy (Bupivacain hydroclorid 5mg/ml), SĐK: VN-20879-17, các lô: 04DB1119, lô 07DB0919 và lô 08DB0919, thuốc do Công ty Warsaw Pharmaceutical Work Polfa S.A (Poland) sản xuất, Công ty cổ phần dược phẩm Trung ương CPC1 nhập khẩu.
Theo các công văn đã có 03/04 ca ADR nghiêm trọng (tử vong) sau khi dùng thuốc trên để gây tê tủy sống.

Công văn khẩn của Cục Quản lý Dược.
Cục Quản lý Dược đã đề nghị các Sở Y tế, các bệnh viện trực thuộc Bộ Y tế trong thời gian chờ xác định nguyên nhân tai biến, khẩn trương chỉ đạo các cơ sở khám chữa bệnh không tiếp tục sử dụng thuốc Dung dịch thuốc tiêm Bupivacaine WPW Spinal 0,5% Heavy, SĐK: VN-20879-17, các lô: 04DB1119, 07DB0919 và lô 08DB0919.
Đồng thời, chỉ đạo các cơ sở sử dụng trên địa bàn đảm bảo cung ứng và tìm nguồn thay thế trong trường hợp cần thiết đối với thuốc tiêm chứa Bupivacain; tăng cường công tác dự phòng, phát hiện và xử lý tai biến có thể xảy ra trong quá trình sử dụng dung dịch thuốc tiêm Bupivacaine WPW Spinal 0,5% Heavy, SĐK: VN-20879-17.
Cục Quản lý Dược cũng đề nghị các cơ sở sản xuất kinh doanh thuốc khẩn trương rà soát tình hình tồn kho, đảm bảo cung ứng thuốc, chủ động tăng cường nguồn cung trong trường hợp có nhu cầu thay thế thuốc.
Yêu cầu Công ty cổ phần dược phẩm Trung ương CPC1 rà soát tình hình phân phối, sử dụng Dung dịch thuốc tiêm Bupivacaine WPW Spinal 0,5% Heavy, SĐK: VN-20879-17, số lô: 07DB0919, 08DB0919 và 04DB1119, thông báo đến các đơn vị liên quan không tiếp tục phân phối, sử dụng các lô thuốc trên cho đến khi có ý kiến kết luận cuối cùng của các cơ quan chức năng liên quan.
Trước đó, tháng 10/2020, xuất hiện một trường hợp một sản phụ tử vong tại Quảng Ngãi có sử dụng thuốc Bupivacaine WPW Spinal 0,5 % Heavy.
Theo Báo Quảng Ngãi, vào ngày 13/10, bệnh nhân tên D. nhập vào Bệnh viện Đa khoa tư nhân Phúc Hưng trong tình trạng đau bụng. Bác sĩ chẩn đoán sản phụ mang thai lần hai, 39 tuần, ngôi đầu tiền chuyển dạ/vết mổ cũ.
Tiếp nhận bệnh nhân, các bác sĩ tiến hành gây tê tuỷ sống bằng thuốc Bupivacaine WPW Spinal 0,5 % Heavy (do Ba Lan sản xuất).
Khoảng năm phút sau, sản phụ xuất hiện đau tê vùng mông rồi co giật hai chân. Bệnh nhân sau đó được chuyển Bệnh viện đa khoa tỉnh Quảng Ngãi hồi sức, sau đó chuyển đến TP Đà Nẵng nhưng tình trạng bệnh nhân yếu dần rồi tử vong.
Ngay sau vụ việc trên, Sở Y tế Quảng Bình đã yêu cầu Bệnh viện Đa khoa tư nhân Phúc Hưng gửi hồ sơ của sản phụ để phân tích, đánh giá. Đồng thời, Bệnh viện Đa khoa tư nhân Phúc Hưng chủ động ngưng sử dụng Bupicavaine.
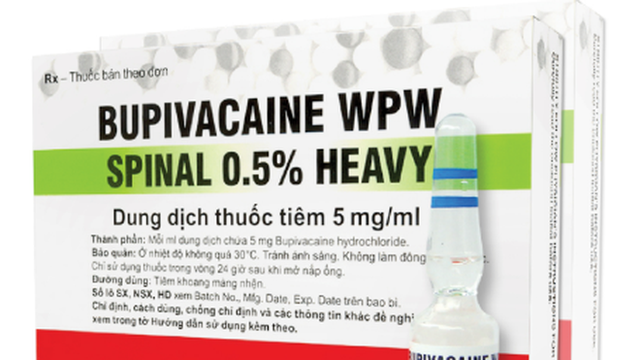
Dung dịch thuốc tiêm Bupivacaine WPW Spinal 0,5% Heavy.
Tháng 6/2020, Sở Y tế Quảng Bình nhận được Báo cáo số 312/BC-BV ngày 08/6/2020 của Bệnh viện Đa khoa Khu vực Bắc Quảng Bình về việc Báo cáo nhanh trường hợp tử vong liên quan người bệnh được gây tê tủy sống (chẩn đoán chỉ định: nội soi niệu quản ngược dòng tán sỏi bằng Laser) bằng thuốc Bupivacaine WPW Spinal 0,5% Heavy (SĐK: VN-20879-17; số lô: 04DB0919; ngày sản xuất: 11/9/2019; hạn sử dụng: 11/9/2021; nước sản xuất: Ba Lan). Sau khi gây tê khoảng 10 phút, người bệnh đột ngột ngừng tuần hoàn, hô hấp.
P. Thủy Những “đoá hoa” lặng lẽ toả hương
Những “đoá hoa” lặng lẽ toả hươngTrách nhiệm công việc, nghĩa cử nhân văn của những người thầy thuốc không chỉ gửi gắm thông điệp yêu thương mà còn giúp hương vị Tết thêm phần ngọt ngào, ấm áp giữa tiết trời se lạnh.