Dung dịch thuốc tiêm Protamine Choay 1000 U.A.H/ml bị thu hồi
Do có hoạt tính trung hòa tác động chống đông của Heparin giảm khoảng 25% so với hoạt tính ghi trên nhãn nên 17 lô thuốc tiêm Protamine Choay 1000 U.A.H/ml đã bị thu hồi...
Văn phòng đại diện Tedis cộng hòa Pháp tại TP Hồ Chí Minh đã có văn thư số 99/2020/TD-QA ngày 27/10/2020 và số 103/2020/TD-QA ngày 03/11/2020 gửi Cục Quản lý Dược về việc tự nguyện thu hồi dung dịch thuốc tiêm Protamine Choay 1000 U.A.H/ml (Protamin sulfat 1000 U.A.H/ml) do Công ty Famar Health Care Service Madrid, S.A.U - Tây Ban Nha sản xuất, Công ty Sanofi Aventis (Pháp) sở hữu Giấy phép lưu hành và Công ty Tedis (Pháp) cung cấp.
Các lô thuốc thu hồi: Gồm 17 lô thuốc, trong đó, có 4 lô hiện đang lưu hành tại Việt Nam (do Công ty cổ phần dược phẩm Trung ương CPC1, Công ty CP XNK Y tế TP Hồ Chí Minh Yteco nhập khẩu). Cụ thể, 4 lô dung dịch thuốc tiêm là lô 147000A, HD: 10/2020; lô 157880A, HD: 02/2021; lô 157870A, HD: 02/2021 và lô 182610A, HD: 09/2021.
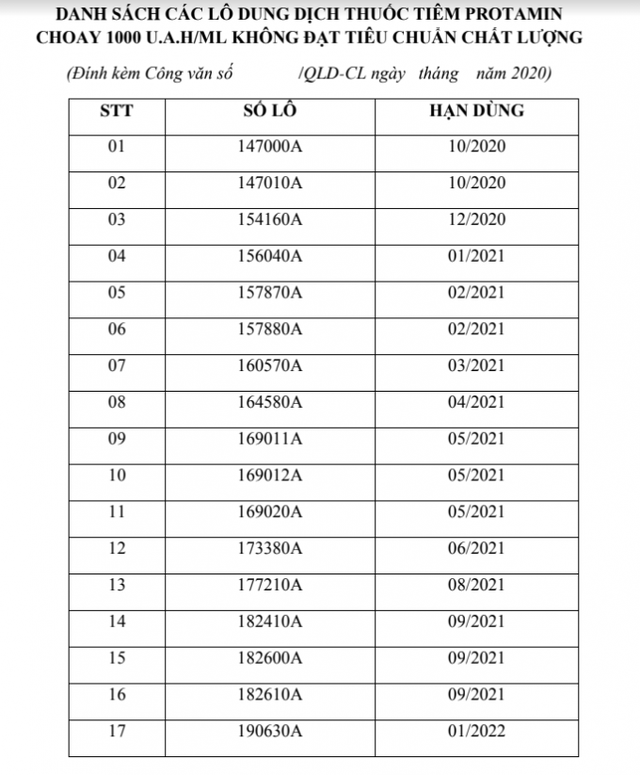
Nguyên nhân thu hồi là do dung dịch thuốc tiêm Protamine Choay 1000 U.A.H/ml có hoạt tính trung hòa tác động chống đông của Heparin giảm khoảng 25% so với hoạt tính ghi trên nhãn.
Cục Quản lý Dược đã đồng ý với đề xuất của Công ty Sanofi Aventis France và Văn phòng đại diện Tedis cộng hòa Pháp về việc tự nguyện thu hồi các lô thuốc Protamine Choay 1000 U.A.H/ml không đạt chất lượng nêu trên.
Đồng thời, để đảm bảo an toàn và hiệu quả cho người sử dụng, Cục Quản lý Dược yêu cầu Văn phòng đại diện Tedis cộng hòa Pháp tại TP Hồ Chí Minh phối hợp Công ty cổ phần dược phẩm Trung ương CPC1, Công ty CP XNK Y tế TP Hồ Chí Minh (Yteco) và các nhà phân phối gửi thông báo thu hồi tới các cơ sở khám chữa bệnh, sử dụng trên toàn quốc và tiến hành thu hồi đối với 4 lô dung dịch thuốc tiêm Protamine Choay 1000 U.A.H/ml (Protamin sulfat 1000 U.A.H/ml) đang lưu hành trên thị trường Việt Nam.
Báo cáo kết quả thu hồi về Cục Quản lý Dược trước ngày 24/11/2020.
Hồ sơ thu hồi bao gồm số lượng sản xuất, số lượng phân phối, ngày sản xuất, số lượng thu hồi, các bằng chứng về việc thực hiện thu hồi tại các cơ sở khám chữa bệnh, sử dụng đã mua thuốc theo quy định tại Thông tư số 11/2018/TT-BYT ngày 04/05/2018 của Bộ Y tế quy định về chất lượng thuốc, nguyên liệu làm thuốc.
Ngoài ra, Cục còn yêu cầu các cơ sở nhập khẩu, phân phối thuốc phối hợp với nhà sản xuất, Công ty Sanofi Aventis (Pháp) khẩn trương có phương án nhập khẩu các lô thuốc Protamin Choay 1000 A.U.H/ml để kịp thời cung cấp cho các cơ sở khám chữa bệnh, tránh tình trạng thiếu thuốc.
Không nhập khẩu, cung cấp các lô thuốc Protamine Choay 1000 U.A.H/ml bị giảm hoạt tính trung hòa tác động chống đông của Heparin đã bị thu hồi. Chỉ được phân phối và cung cấp vào thị trường các lô thuốc Protamin Choay 1000 U.A.H/ml được Cục Quản lý Dược cấp đơn hàng nhập khẩu thuốc chưa có số đăng ký lưu hành tại Việt Nam và đã được kiểm nghiệm đạt tiêu chuẩn chất lượng.
Cùng với đó, Cục đã đề nghị Sở Y tế TP Hà Nội kiểm tra và giám sát Công ty cổ phần dược phẩm Trung ương CPC1, Sở Y tế TP Hồ Chí Minh kiểm tra và giám sát Công ty CP XNK Y tế TP Hồ Chí Minh (Yteco) thực hiện theo yêu cầu của Công văn này, xem xét xử lý vi phạm theo quy định hiện hành.
Hoàng Mai Những “đoá hoa” lặng lẽ toả hương
Những “đoá hoa” lặng lẽ toả hươngTrách nhiệm công việc, nghĩa cử nhân văn của những người thầy thuốc không chỉ gửi gắm thông điệp yêu thương mà còn giúp hương vị Tết thêm phần ngọt ngào, ấm áp giữa tiết trời se lạnh.